I “sarcomi” sono, in prima approssimazione, i tumori del tessuto connettivo. In particolare essi si distinguono dai tumori “epiteliali”, cioè quelli originanti dagli epiteli.
La maggior parte dei tumori è di tipo epiteliale, comprendendo i tessuti ghiandolari (ad esempio la mammella), il rivestimento interno agli organi cavi (ad esempio l’intestino o i bronchi), la cute, etc.
Vi sono poi i tumori del sangue e degli organi linfatici e i tumori del sistema nervoso centrale. Peraltro, siccome il tessuto connettivo è rappresentato anche negli organi che più spesso danno origine a tumori epiteliali (mammella, tubo gastroenterico, etc.), anche in questi organi possono originare dei sarcomi.
In tal caso, tutte le caratteristiche del tumore sono quelle di un sarcoma, non del corrispondente tumore epiteliale. Nel complesso, i sarcomi sono dunque tumori “rari”.
Considerando tutti i sarcomi insieme, i nuovi casi sono pochissime migliaia ogni anno in Italia. Qualora scorporati nei vari sottogruppi, la loro incidenza è ovviamente ancora più bassa.
E’ importante considerare che la rarità non è affatto sinonimo di maggiore gravità. Molti dei progressi dell’oncologia degli ultimi decenni hanno infatti riguardato proprio i tumori rari.
Semplicemente, i tumori rari sono più difficili da studiare, perché è più difficile realizzare grosse casistiche, e può essere più difficile per il paziente trovare centri con esperienza specifica.
Per tutto questo è vitale la collaborazione fra i centri che si occupano di tumori rari, nell’assistenza come nella ricerca. Nell’oncologia di oggi, peraltro, la ricerca procede in maniera molto omogenea, con una rapida condivisione delle nuove conoscenze.
Generalmente, quando si legge una notizia sui giornali relativamente ad un progresso recente, essa è ormai da tempo patrimonio di tutte le istituzioni, in tutto il mondo, che si occupano regolarmente della patologia in questione.
Nell’ambito dei sarcomi si possono distinguere i sarcomi ossei, che cioè insorgono nello scheletro, e i sarcomi delle parti molli (o dei “tessuti molli”). I sarcomi ossei sono per lo più rappresentati, nel bambino o nell’adolescente, dall’osteosarcoma e dal sarcoma di Ewing.
Questi tumori possono peraltro comparire anche nell’età adulta, e in tal caso hanno le stesse caratteristiche che assumono in età più precoce.
Analogamente, un tumore come il sarcoma di Ewing può originare dalle parti molli anziché dallo scheletro, e in tal caso ha sostanzialmente le stesse caratteristiche della forma primariamente ossea.
Nell’adulto, vi sono poi altri tumori ossei, più rari, come il condrosarcoma, il cordoma, e altri ancora. I sarcomi delle parti molli sono invece tipici dell’adulto, tranne una varietà, il rabdomiosarcoma, che è tipico dell’età pediatrica (ancora salvi alcuni casi in cui compare in età adulta).
Vi sono molte varietà istologiche nell’ambito dei sarcomi dei tessuti molli (ad esempio, liposarcoma, leiomiosarcoma, fibrosarcoma, etc.).
Anche se la storia naturale di un sarcoma dei tessuti molli tipico dell’adulto tende ad essere per molti aspetti la stessa indipendentemente dall’istologia possono esservi alcune differenze, anche nella responsività ai trattamenti.
Soprattutto, i sarcomi dei tessuti molli comprendono forme ad alto grado di malignità e forme a basso grado di malignità. Mentre tutti i sarcomi possono recidivare localmente, cioè ricomparire dopo l’asportazione chirurgica nella stessa sede di partenza, sono soprattutto i sarcomi ad alto grado a potere recidivare anche a distanza, cioè in altri organi.
Un organo che è particolarmente esposto in questo senso è il polmone. Questo giustifica l’effettuazione sistematica di esami di controllo, dopo la chirurgia per il tumore primitivo, incentrati sui polmoni (radiografia del torace, TAC del torace), e la frequenza con cui nei sarcomi viene praticata l’asportazione chirurgica delle lesioni secondarie polmonari.
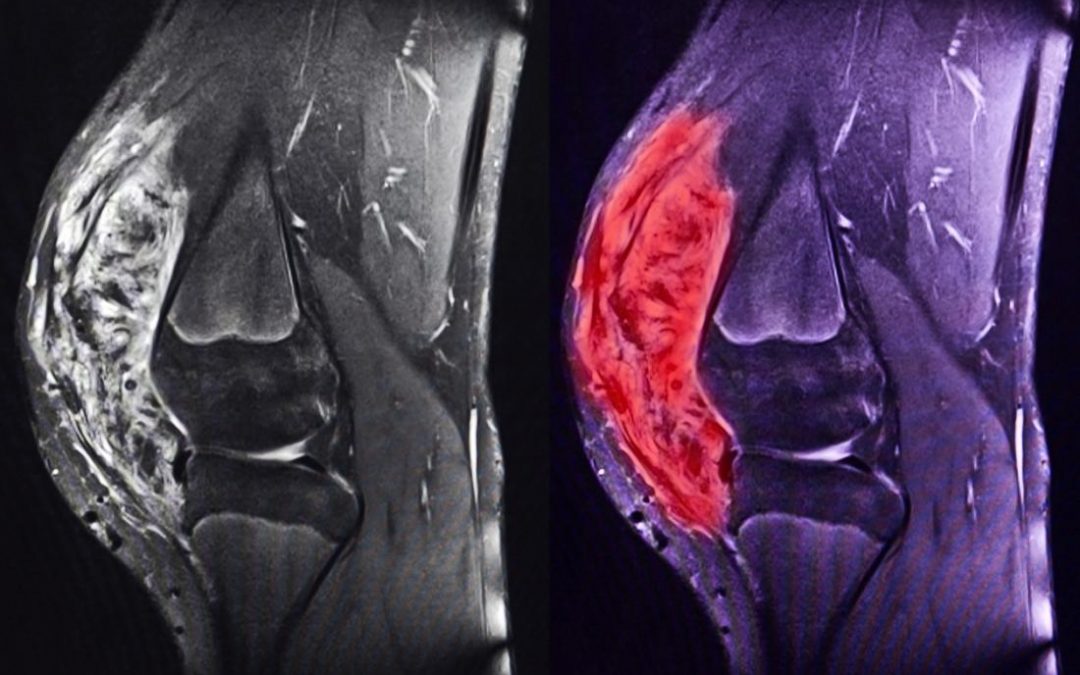
Altre sedi di possibile diffusione sono lo scheletro e i tessuti molli distanti da quelli di origine. E’ dunque molto importante la diagnosi istologica, in quanto rappresenta l’elemento sul quale viene impostato tutto il programma terapeutico.
La rarità dei sarcomi e la loro complessità, con la possibilità di presentazioni atipiche e ancora più rare, rende il momento della diagnosi istologica un momento critico.
Questo è il motivo per cui comunque ogni programmazione terapeutica presuppone in genere un accertamento istologico, cioè una biopsia, che può essere effettuata con una semplice manovra ambulatoriale, ma che in diversi casi richiede un vero e proprio, per quanto spesso limitatissimo, intervento chirurgico.
Anche nel campo della diagnosi patologica, è molto importante la collaborazione fra i patologi per il miglioramento della qualità di diagnosi così rare e complesse.
E’ anche importante che il patologo e il clinico collaborino strettamente e dialoghino fra loro sistematicamente, sia perché il clinico possa essere consapevole di tutte le implicazioni della diagnosi patologica, sia perché il patologo conosca fino in fondo al momento della diagnosi la presentazione clinica del caso che sta esaminando.Infatti, l’approccio terapeutico a un caso di sarcoma dovrebbe sempre essere di tipo “multidisciplinare”.
E’ quindi opportuno che ogni paziente con sarcoma venga considerato da un gruppo multidisciplinare, comprendente un chirurgo esperto nella patologia, un radioterapista, un oncologo medico.
Figure altrettanto importanti sono quelle del riabilitatore e del palliativista. La necessità di un approccio multidisciplinare e la rarità dei sarcomi rendono ragione del fatto che la migliore qualità di cura si raggiunge nelle istituzioni che abbiano esperienza nei sarcomi e che possano mettere in atto un approccio multidisciplinare.
Naturalmente anche la collaborazione clinica a distanza può consentire nei fatti un approccio multidisciplinare. L’approccio ai sarcomi si differenzia innanzitutto a seconda che si tratti di forme giovanili come l’osteosarcoma, il sarcoma di Ewing o il rabdomiosarcoma, oppure di forme più tipiche dell’adulto, come i sarcomi dei tessuti molli.
Nell’osteosarcoma, nel sarcoma di Ewing e nel rabdomiosarcoma, la chemioterapia è sempre fondamentale ed ha consentito di ottenere alcuni fra i più grossi successi dell’oncologia degli ultimi decenni.
La prognosi di questi sarcomi è infatti drammaticamente migliorata grazie all’introduzione della chemioterapia, che è pressoché sempre inclusa nel programma di trattamento.
Questo non vuol dire rinunciare alla chirurgia, che è comunque inclusa, di regola, nel trattamento dell’osteosarcoma e in molti casi di sarcoma di Ewing o rabdomiosarcoma. D’altra parte, la chirurgia è propriamente centrale nei sarcomi dei tessuti molli dell’adulto.
Anche in questi sarcomi, comunque, la radioterapia e la chemioterapia possono giocare un ruolo importante, in rapporto all’istologia ed alla presentazione clinica.
Accanto al miglioramento della prognosi, particolarmente delle forme giovanili, un’evoluzione importante degli ultimi decenni è stata anche la diffusione di una chirurgia “conservativa” per le forme a partenza dagli arti.
Questo ha fatto scendere drammaticamente il numero delle amputazioni, oggi poco frequenti. Sia i miglioramenti tecnologici di ambito chirurgico sia i trattamenti multidisciplinari hanno consentito questo progresso, così importante per la qualità di vita dei pazienti con sarcoma.
La terapia medica dei sarcomi ha anch’essa fatto progressi importanti e sta ora valutando nuovi farmaci, da affiancare a quelli già usati da diversi anni, come l’adriamicina (o l’epirubicina) e l’ifosfamide in tutti i sarcomi; nell’osteosarcoma, anche il cis-platino e il methotrexate ad alte dosi; nel sarcoma di Ewing, anche l’actinomicina D e l’etoposide.
Un nuovo farmaco che sta fornendo risultati di grande rilievo è l’Imatinib (Glivec®) nei tumori stromali gastroenterici, una particolare varietà di sarcomi del tubo gastroenterico.
Un aspetto particolarmente importante è la selettività di azione di questo farmaco, rivolto verso il prodotto della mutazione di un oncogene (c-kit), dimostratasi in grado di consentire una grande efficacia e una notevole limitazione negli effetti collaterali.
Peraltro, anche gli effetti collaterali della chemioterapia “classica” sono oggi assai più contenuti di qualche anno fa, grazie ai progressi nella terapia sintomatica e di supporto.
Spesso, i trattamenti multidisciplinari dei sarcomi si sviluppano nell’arco di molti mesi e quindi, al di là degli effetti collaterali dei singoli trattamenti, essi risultano gravosi soprattutto per la lunghezza dell’intervallo di tempo richiesto per il completamento del programma terapeutico complessivo.
E’ importante che il paziente abbia ben chiaro che l’obiettivo di questi trattamenti è la guarigione e inoltre che mantenga quanto possibile la sua normale qualità di vita, proseguendo al massimo le sue occupazioni usuali.
Questo è assai più fattibile di quanto non possa apparire a prima vista.
Analogamente, le sequele a distanza tendono ad essere limitate, ed è ormai altissimo il numero di pazienti che, avendo avuto un sarcoma in giovane età, hanno poi condotto una vita del tutto normale.
Naturalmente, è importante affrontare con il proprio oncologo il problema degli effetti collaterali di breve periodo e delle possibili sequele a distanza.
Generalmente, questo contribuisce a tranquillizzare il paziente, consentendogli una prospettiva di lungo periodo e di normalità.
In linea di principio, il rischio di recidiva dopo un trattamento che abbia eliminato la malattia “visibile” tende sempre a diminuire nel tempo, più o meno velocemente a seconda della varietà di sarcoma.
Anche quando il rischio, dopo diversi anni, non possa propriamente considerarsi uguale a zero, occorre considerare che esso può essere talmente basso da risultare inferiore a tanti altri rischi della vita di qualunque essere umano.
Nel periodo in cui il rischio è ancora alto, è importante sapere che vi sono molti trattamenti in grado di affrontare efficacemente anche la recidiva di malattia. Il rischio della recidiva non dovrebbe in alcun modo compromettere una vita pienamente normale, tanto più in situazioni di probabile guarigione.
La chirurgia dei sarcomi ha fatto grandi progressi negli ultimi decenni, ottenendo in particolare nella drastica diminuzione del numero di amputazioni uno dei suoi successi maggiori.
Anche la chirurgia ricostruttiva ha fatto grandi progressi e dunque consente oggi di affrontare demolizioni importanti con la prospettiva di un recupero funzionale ed estetico spesso assai buono.
E’ importante affrontare con il chirurgo il problema delle consguenze funzionali ed estetiche della chirurgia prima dell’intervento. A volte, vi è uno spazio importante per una decisione condivisa fra medico e paziente sul migliore approccio chirurgico, così da considerare le esigenze del singolo paziente in termini di qualità di vita attesa.
Peraltro, anche la qualità di vita dopo interventi chirurgici demolitivi può essere molto migliore di quanto non si pensi, soprattutto in termini funzionali (ad esempio, la capacità di camminare può essere mantenuta molto bene dopo diversi tipi di amputazione a carico degli arti inferiori).
La radioterapia viene spesso utilizzata per migliorare l’adeguatezza chirurgica e quindi, indirettamente, anche per consentire approcci chirurgici meno demolitivi.
Altre volte, come nel sarcoma di Ewing o nel rabdomiosarcoma, la radioterapia può avere un ruolo essenziale nel programma terapeutico. I suoi effetti collaterali dipendono molto dalla sede anatomica in cui viene effettuata e sono in linea di massima limitati a tale sede.
A volte, la radioterapia può indurre un indurimento dei tessuti o un ostacolo al ritorno della linfa e dunque comportare qualche sequela a distanza (ad esempio un gonfiore permanente di un arto), da affrontare con le terapie fisiche e riabilitative.
La chemioterapia classica viene in genere effettuata attraverso cicli successivi, ad esempio mediante somministrazione dei farmaci in uno o più giorni ogni tre o quattro settimane.
Essa comporta per lo più effetti acuti o subacuti, cioè limitati al periodo di chemioterapia. Spesso cadono i capelli per tutta la durata del programma chemioterapico (ricrescendo però completamente al termine), tra un ciclo e il successivo diminuiscono per qualche giorno i globuli bianchi (che proteggono dalle infezioni) e le piastrine (che prevengono i sanguinamenti), possono verificarsi infiammazioni delle mucose (ad esempio della bocca), vi può essere nausea in coincidenza con la somministrazione dei farmaci.
Sia la chemioterapia che la radioterapia (in alcune sedi anatomiche) possono comportare sequele sulla fertilità, e di questo è importante discutere con l’oncologo prima di inziare il programma terapeutico.
Altri effetti a distanza su altri organi “nobili” vengono invece di norma evitati in quanto la terapia viene programmata in maniera idonea a prevenirli. Dunque, la chemioterapia tende a produrre soprattutto effetti di breve periodo, per lo più limitati a pochi giorni in ciascun ciclo.
Questo è sufficiente, in genere, a far sì che il paziente possa mantenere una vita quasi normale per tutta la durata del programma di trattamento. Gli antiemetici oggi disponibili, i fattori di crescita per il midollo osseo e diversi altri farmaci di supporto contribuiscono a rendere la chemioterapia un trattamento assai meglio tollerato oggi rispetto ad alcuni anni fa.
Alcuni farmaci, poi, sono sprovvisti di alcuni effetti collaterali (ad esempio la caduta dei capelli) ritenuti in genere un corollario inevitabile della chemioterapia.
Quanto sopra accenna soltanto ad alcuni argomenti di frequente discussione fra l’oncologo e il suo paziente.
Una buona relazione con l’oncologo (spesso, bisognerebbe dire, con tutto il team oncologico) è uno strumento importante per potere affrontare al meglio il periodo di trattamento e per assumere in piena consapevolezza le decisioni fondamentali sulla strategia terapeutica, in modo che queste si riflettano in una condivisione completa del programma terapeutico, definito nel singolo paziente anche tenendo conto delle sue esigenze più personali.